Research
はじめにシナプスありき
私たちの脳は視覚情報、聴覚情報、運動機能などそれぞれの機能を発揮す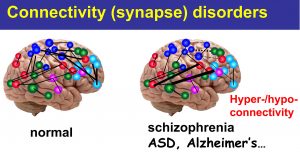 る神経回路網によって成り立っています。神経回路網は、約1000億個の神経細胞が、それぞれお互いに「シナプス」という結び目によって繋がることによって形成されます。それぞれの神経細胞には平均して1万個ほどのシナプスがありますので、シナプスの数はなんと1000兆個に達するとされています。このようなシナプスは一体どのようにして形成されるのでしょうか?最近の研究成果の結果、シナプスは遺伝情報に基づいて形成されるのみではなく、生後の環境因子や経験・学習によって生涯に亘って機能的にも形態的にもに変化を受け続けます。シナプスこそが、私たちヒトをヒトたらしめる根源です。実際、近年の研究成果によって、うつ病・統合失調症などの精神疾患や、自閉スペクトラム症などの発達障害、さらにアルツハイマー病を初めとする認知症などの神経疾患は「シナプス病」であると考えられています。
る神経回路網によって成り立っています。神経回路網は、約1000億個の神経細胞が、それぞれお互いに「シナプス」という結び目によって繋がることによって形成されます。それぞれの神経細胞には平均して1万個ほどのシナプスがありますので、シナプスの数はなんと1000兆個に達するとされています。このようなシナプスは一体どのようにして形成されるのでしょうか?最近の研究成果の結果、シナプスは遺伝情報に基づいて形成されるのみではなく、生後の環境因子や経験・学習によって生涯に亘って機能的にも形態的にもに変化を受け続けます。シナプスこそが、私たちヒトをヒトたらしめる根源です。実際、近年の研究成果によって、うつ病・統合失調症などの精神疾患や、自閉スペクトラム症などの発達障害、さらにアルツハイマー病を初めとする認知症などの神経疾患は「シナプス病」であると考えられています。
私たちは何を研究しているのでしょう?
神経活動に応じて、シナプスでの信号伝達の効率が長期間上昇する現象(長期増強:Long-term potentiation (LTP))や低下する現象(長期抑圧:Long-term depression (LTD))が知られています。このような変化こそが、短期から中期記憶(ヒトの場合は時間~日の単位)の実体と考えられています。一方、より長期の記憶(月~年)は、シナプスそのものが新しく形成されたり消滅したりされるような形態的な変化によって担われていると考えられています。柚﨑研では、この2つの現象:①シナプスの機能的な変化(LTP/LTD)、②シナプス形成・維持・除去といった形態的な変化、が一体どのような分子機構によって担われ、個体レベルでの神経回路や行動の変化にどのように関与するのかを解明することを目指しています。
それは一体どんなことに役に立つのでしょうか?
シナプスがどのように機能的に変化し、あるいはシナプスがどのように形成され、維持され、そして失われていくのか、という過程を解明することは、シナプス異常に原因をもつさまざまな精神・神経疾患や発達障害の病態を理解し、新しい治療法を開発するためにはとても重要です。以下のような様々な発展が考えられます。しかし、大事なことは、シナプスで起きている現象をよりよく理解することであり、応用方法はその後からついてくると信じています。
- どうして一定の学習は幼児期のみに成立するか(三つ子の魂百までも)を分子レベルで解明することによって健やかな脳を育む
- 精神疾患・発達障害を引き起こすシナプスでの異常を解明することによって、新しい根源的な診断法・治療法に繋げる
- 神経細胞死が起きる前に、シナプスレベルで介入することによる認知症の進行を阻止する
- iPS細胞由来神経細胞移植による再生医学において、シナプス形成を促進させることによって回復を高める。
具体的にはどんな研究をしているのでしょう…
1)光遺伝学を用いた
LTP/LTD機構の研究
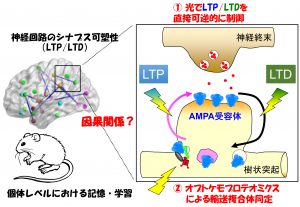
神経活動に応じたシナプス可塑性現象は、人為的にシナプスに加えた電気的刺激に応じて起きる長期増強(LTP)や長期抑圧(LTD)をモデルとして長年研究されてきました。しかし、このようにして引き起こされるLTP/LTDが、個体レベルにおける記憶・学習と因果関係が本当にあるのか、という根源的な問いは未解決のまま残されています。私たちは、光刺激によって、狙ったシナプスにおいて急性かつ可逆的にLTDを直接操作できる光遺伝学的ツール(PhotonSABER)を開発することによって、小脳における運動学習がLTDによって担われていることを直接証明することに成功しました(Neuron, 2018)。このようなツールをさらに開発することによって、短期から中期記憶の実体を担う分子機構の解明を目指しています。
2)補体ファミリーを中心としたシナプス形成分子の研究
自然免疫系で異物を認識する分子である「補体C1q」は進化的にとても古い分子です。面白いことに、C1qに似た分子群(補体ファミリー分子)は免疫系だけではなく、中枢神経系においてシナプス形成・成熟過程を制御することを私たちは発見しました。
小脳においては、顆粒細胞の軸索である平行線維はプルキンエ細胞の樹状突起とシナプスを形成します。平行線維からは補体ファミリー分子Cbln1が分泌され、平行線維に存在するニューレキシン(Nrx)と結合すると同時に、プルキンエ細胞に存在するδ2型グルタミン酸受容体(GluD2)にも結合します。このNrx-Cbln1-GluD2からなる三者複合体が、平行線維とプルキンエ細胞の間のシナプスの接着に必須であることを私たちは報告しました(Science 2010; 2016)。下オリーブ核の軸索である登上線維もプルキンエ細胞の樹状突起とシナプスを形成します。登上線維からは補体ファミリー分子のC1ql1が分泌され、プルキンエ細胞に存在する7回膜貫通型接着分子であるBai3と結合することにより登上線維ープルキンエ細胞シナプスの成熟と維持を制御することを私たちは見出しました(Neuron 2014)。平行線維-プルキンエ細胞、登上線維ープルキンエ細胞という2種類のシナプスにおいて、Cbln1, C1ql1という異なった補体ファミリー分子がそれぞれ放出され、競い合うようにしてプルキンエ細胞の樹状突起上にシナプス形成を引き起こすのはとても興味深いと思います。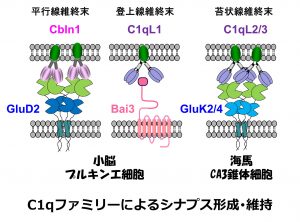
私たちの脳における興奮性神経伝達を担うのはグルタミン酸受容体ですが、グルタミン酸受容体の中でもAMPA受容体は速い神経伝達を、カイニン酸受容体は遅い伝達を担います。脳の中でカイニン酸受容体は海馬のCA3錐体細胞に高く発現し、とりわけ苔状線維(歯状回顆粒細胞の軸索)が作るシナプス後部に集積することにより、神経活動の時間的・空間的な加算を引き起こすために重要な働きをします。一方、側頭葉てんかんにおいてはこのカイニン酸受容体がその加算性によっててんかん焦点形成に大きな役割を果
たします。これまで苔状線維シナプス後部にカイニン酸受容体がどうして集積するのかは全くの謎でした。私達は苔状線維から分泌される補体ファミリー分子C1qL2とC1ql3こそが、CA3錐体細胞において苔状線維シナプス後部へのカイニン酸受容体の集積を決定する分子であることを発見しました(Neuron, 2016)。補体ファミリー分子は神経活動によって合成されたり、分泌されたりする性質をもち、炎症とも関連が深いため、さまざまな疾患の病態に関与することが予想されています。
3)人工シナプスコネクターの開発
脳のさまざまな神経回路を構成しているシナプスが、どのようなシナプス形成分子によって形成・維持されるのかを解明することによって、自然には存在しない特性をもった人工シナプスコネクターを開発することができます。これまでに、すべての
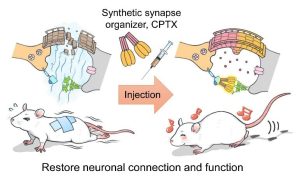
脳神経回路の興奮性シナプスに存在するグルタミン酸受容体と結合するNeuronal pentraxin 1(Nptx1)の結晶構造を解明し、その構造を小脳において強力なシナプス形成能を示すCbln1と組み合わせることによって、新しい人工シナプスオーガナイザーCPTX(=Cbln1 + Nptx1)の開発に成功しました(Science 2020)。CPTXは
小脳以外の神経回路でも強力にシナプスを接続できる特性を持ち、CPTXを小脳失調、アルツハイマー病、脊髄損傷のモデルマウスに投与すると、数日以内にシナプスが形成され、協調運動の改善、学習・記憶機能の回復、麻痺した後ろ足の運動機能の回復など、それぞれの病態について著しい改善を導くことができました。このような人工シナプスコネクターの開発によって、自閉スペクトラム症、統合失調症、アルツハイマー病などのシナプス病に対する新しい治療戦略の創出・応用につながることが期待されます。
—English version—
In the Beginning was the Synapse
Approximately 100 billion neurons connect each other by “synapses” to form various neural circuits in the human brain. While the number of synapses can reach 1,000 trillion, how synapses are actually formed in a circuit- and neuron-specific manner remains incompletely understood. Recent imaging studies have shown that synapses are not only formed by genetic information, but also continuously modified by neuronal activities throughout life. Furthermore, it has become increasingly clear that many neurodevelopmental, neuropsychiatric and neurological disorders, such as autism spectral disorders, schizophrenia and Alzheimer’s diseases, are caused by defects in synaptic functions. Therefore, it is essential to clarify how synapses are formed, maintained and modified to better understand how our brain functions and dysfunctions in physiological and pathological conditions, respectively. Toward this goal, we are focusing on two major projects as follows:
What do we study?
1) Changes in functional synaptic connectivity by neuronal activities
Synaptic connectivity is functionally modified by changes in neuronal activities, a phenomenon known as synaptic plasticity. Long-term potentiation (LTP) and long-term depression (LTD) of excitatory neurotransmission have been intensively studied as models of synaptic plasticity mediating learning and memory. While it has become clear that LTP and LTD are mainly caused by activity-induced increase and decrease in the number of postsynaptic AMPA-type glutamate receptors (AMPARs) that directly mediates fast excitatory neurotransmission, respectively, it remains incompletely clear whether and how LTP and LTD are causally linked to brain functions mediating specific behavioral changes in vivo. To address this question, Yuzaki laboratory is developing optogenetic tools that can directly regulate LTP and LTD in living animals.
2) Changes in structural synaptic connectivity by synaptic organizers
Molecules that regulate synapse formation, maintenance and modification are referred to as synaptic organizers. They are classified into two major classes, cell-adhesion molecules, such as neurexin and neuroligin, and secreted diffusible factors, such as Wnt and FGF. Interestingly, certain secreted factors are retained in the extracellular matrix at the synaptic cleft and serve as extracellular scaffolds for pre- and post-synaptic proteins, and thus referred to as extracellular scaffolding proteins (ESPs). The ESP-type of synaptic organizers includes neuronal pentraxins and C1q family proteins, which is characterized by the presence of the C-terminal globular C1q domain. C1q, the prototype of the C1q family, belongs to the complement innate immune system and recognizes various foreign objects. Yuzaki laboratory has found that C1q family proteins, such as cerebellins (Cblns) and C1q-like proteins (C1qLs) are predominantly expressed in the CNS and have been characterizing their functions at synapses.
—
Recent representative papers (Since 2005 ):
For details:  https://orcid.org/0000-0002-5750-3544
https://orcid.org/0000-0002-5750-3544
- Kakegawa W*, Paternain AV, Matsuda K, Isabel AM, Iida I, Miura E, Nozawa K, Yamasaki T, Sakimura K, Yuzaki M**, Lerma J*. Kainate receptors regulate synaptic integrity and plasticity by forming a complex with synaptic organizers in the cerebellum. Cell Reports 43:114427, 2024.
- Itoh M, Piot L, Mony L, Paoletti P*, Yuzaki M.* Lack of evidence for direct ligand-gated ion channel activity of GluD receptors Proc Natl Acad Sci USA 121:e2406655121, 2024.
- Nozawa K, Sogabe T, Hayashi A, Motohashi J, Miura E, Arai I, Yuzaki M*. In vivo nanoscopic landscape of neurexin ligands underlying anterograde synapse specification. Neuron 110:3168-3185, 2022..
- Ojima K†, Kakegawa W†, Yamasaki T, Miura Y, Itoh M, Michibata Y, Kubota R, Doura T, Miura E, Nonaka H, Mizuno S, Takahashi S, Yuzaki M*, Hamachi I*, Kiyonaka S**. Coordination chemogenetics for activation of GPCR-type glutamate receptors in brain tissue. Nat Commun. 13(1):3167, 2022.
- Suzuki K†, Elegheert J†, Song I†, Sasakura H†, Senkov O, Matsuda K, Kakegawa W, Clayton AJ, Chang VT, Ferrer-Ferrer M, Miura E, Kaushik R,Ikeno M, Morioka Y, Takeuchi Y, Shimada T, Otsuka S, Stoyanov S, Watanabe M, Takeuchi K, Dityatev A*, Aricescu AR*, Yuzaki M** . A synthetic synaptic organizer protein restores glutamatergic neuronal circuits. Science 369:eabb4853, 2020. (†Co-first, *Co-corresponding, **Lead author)
- Ibata K, Kono M, Narumi S, Motohashi J, Kakegawa W, Kohda K, Yuzaki M. Activity-dependent secretion of synaptic organizer Cbln1 from lysosomes in granule cell axons. Neuron 102:1184-1198, 2019.
- Kono M, Kakegawa W, Yoshida K, Yuzaki M. Interneuronal NMDA receptors regulate long-term depression and motor learning in the cerebellum. J Physiol. 597:903-920, 2019.
- Kakegawa W, Katoh A, Narumi S, Miura E, Motohashi J, Takahashi A, Kohda K, Fukazawa Y, Yuzaki M**, Matsuda S*. Optogenetic Control of Synaptic AMPA Receptor Endocytosis Reveals Roles of LTD in Motor Learning. Neuron 99:985-998, 2018. (*Co-corresponding authors; **Lead author).
- Yuzaki M. Two Classes of Secreted Synaptic Organizers in the Central Nervous System. Annu Rev Physiol 80:243-262, 2018.
- Satake T, Yamashita K, Hayashi K, Miyatake S, Tamura-Nakano M, Doi H, Furuta Y, Shioi G, Miura E, Takeo YH, Yoshida K, Yahikozawa H, Matsumoto N, Yuzaki M, Suzuki S. MTCL1 plays an essential role in maintaining Purkinje neuron axon initial segment. EMBO J 36:1227-1242, 2017.
- Wakayama S, Kiyonaka S, Arai I, Kakegawa W, Matsuda S, Ibata K, Nemoto YL, Kusumi A, Yuzaki M, Hamachi I. Chemical labeling for visualizing native AMPA receptors in live neurons. Nature Commun 8:14850, 2017.
- Yuzaki M, Aricescu AR. A GluD Coming-Of-Age Story. Trends Neurosci 40:138-150, 2017.
- Otsuka S, Konno K, Abe M, Motohashi J, Kohda K, Sakimura K, Watanabe M, Yuzaki M. Roles of Cbln1 in Non-Motor Functions of Mice. J Neurosci, 36:11801-11816, 2016.
- Elegheert J, Kakegawa W, Clay JE, Shanks N, Behiels E, Matsuda K, Kohda K, Miura E, Rossmann M, Mitakidis N, Motohashi J, Chang VT, Siebold C, Greger IH, Nakagawa T, Yuzaki M*, Aricescu AR*. Structural basis for integration of GluD receptors within synaptic organizer complexes. Science 353:295-299, 2016. (*co-corresponding author).
- Kiyonaka S, Kubota R, Michibata Y, Sakakura M, Takahashi H, Numata T, Inoue R, Yuzaki M, Hamachi I. Allosteric activation of membrane-bound glutamate receptors using coordination chemistry within living cells. Nature Chem 8 :958-967, 2016.
- Matsuda K, Budisantoso T, Mitakidis N, Sugaya Y, Miura E, Kakegawa W, Yamasaki M, Konno K, Uchigashima M, Abe M, Watanabe I, Kano M, Watanabe M, Sakimura K, Aricescu AR, Yuzaki M. Trans-synaptic modulation of kainate receptor functions by C1q-like proteins. Neuron 90:752-767, 2016.
- Takeo YH, Kakegawa W, Miura E, Yuzaki M. RORα Regulates Multiple Aspects of Dendrite Development in Cerebellar Purkinje Cells In Vivo. J Neurosci 35:12518-12534, 2015.
- Kakegawa W, Mitakidis N, Miura E, Abe M, Matsuda K, Takeo YH, Kohda K, Motohashi J, Takahashi A, Nagao S, Muramatsu SI, Watanabe M, Sakimura K, Aricescu AR, Yuzaki M. Anterograde C1ql1 signaling is required in order to determine and maintain a single-winner climbing fiber in the mouse cerebellum. Neuron 85:316-329, 2015.
- Matsuda S, Kakegawa W, Budisantoso T, Nomura T, Kohda K, Yuzaki M. Stargazin regulates AMPA receptor trafficking through adaptor protein complexes during long–term depression. Nature Commun 4:2759, 2013.
- Kohda K, Kakegawa W, Matsuda S, Yamamoto T, Hirano H, Yuzaki M. The d2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites. Proc Natl Acad Sci USA 110:E948-957, 2013.
- Ito-Ishida A, Miyazaki T, Miura E, Matsuda K, Watanabe M, Yuzaki M*, Okabe S*. Presynaptically released Cbln1 induces dynamic axonal structural changes by interacting with GluD2 during cerebellar synapse formation. Neuron 76:549-564, 2012. (*co-corresponding author).
- Unoki T, Matsuda S, Kakegawa W, Van UT, Kohda K, Suzuki A, Funakoshi Y, Hasegawa H, Yuzaki M*, Kanaho Y. NMDA receptor-mediated PIP5K activation to produce PI(4,5)P2 is essential for AMPA receptor endocytosis during LTD. Neuron 73: 135-148, 2012. (*co-corresponding author)
- Kakegawa W, Miyoshi Y, Hamase, K, Matsuda S, Matsuda K, Kohda K, Emi K, Motohashi J, Konno R, Zaitsu K, Yuzaki M. D-Serine regulates cerebellar LTD and motor coordination through the delta2 glutamate receptor. Nature Neurosci 14: 603-611, 2011.
- Yuzaki M. Cbln1 and its family proteins in synapse formation and maintenance. Curr Opin Neurobiol 21:215-220, 2011.
- Jitsuki S, Takemoto K, Kawasaki T, Tada H, Takahashi A, Becamel C, Sano A, Yuzaki M, Zukin RS, Ziff EB, Kessels HW, Takahashi T. Serotonin mediates cross-modal reorganization of cortical circuits. Neuron 69: 780-92, 2011.
- Matsuda K, Miura E, Miyzaki T, Kakegawa W, Emi K, Narumi S, Fukazawa Y, Ito-Ishida A, Kondo T, Shigemoto R, Watanabe M, Yuzaki M. Cbln1 is a ligand for an orphan glutamate receptor δ2, a bidirectional synapse organizer. Science 328: 363-368, 2010.
- Nishiyama J, Matsuda K, Kakegawa W, Yamada N, Motohashi J, Mizushima N, Yuzaki M. Reevaluation of neurodegeneration in lurcher mice: constitutive ion fluxes cause cell death with, not by, autophagy. J Neurosci 30:2177-87, 2010.
- Kakegawa, W., Miyazaki, T., Kohda, K., Matsuda, K., Emi, K., Motohashi, J., Watanabe, M., Yuzaki, M. The N-terminal domain of GluD2 (GluRδ2) recruits presynaptic terminals and regulates synaptogenesis in the cerebellum in vivo, J Neurosci 29:5738-5748, 2009.
- Iijima, T., Emi., K., Yuzaki, M. Activity-dependent repression of Cbln1 expression: mechanism for developmental and homeostatic regulation of synapses in the cerebellum. J. Neurosci 29:5425-5434、2009.
- Matsuda S, Miura E, Matsuda K, Kakegawa W, Kohda K, Watanabe M, Yuzaki M. Accumulation of AMPA Receptors in Autophagosomes in Neuronal Axons Lacking Adaptor Protein AP-4. Neuron 57: 1-16, 2008.
- Ito-Ishida, A., Miura, E., Emi, K., Matsuda, K., Iijima, T., Kondo, T., Kohda, K. Watanabe, M., Yuzaki, M. Cbln1 Regulates Rapid Formation and Maintenance of Excitatory Synapses in Mature Cerebellar Purkinje Cells in vitro and in vivo. J Neurosci 28:5920-5930, 2008.
- Kakegawa, W., Miyazaki, T., Emi, K., Matsuda, K., Kohda, K., Motohashi, J., Mishina, M., Kawahara, S., Watanabe, M., Yuzaki, M. Differential Regulation of Synaptic Plasticity and Cerebellar Motor Learning by the C-terminal PDZ-Binding Motif of GluRdelta2. J Neurosci 28:1460-1468, 2008.
- Kakegawa,W., Kohda, K., Yuzaki, M. The delta2 “ionotropic” glutamate receptor functions as a non-ionotropic receptor to control cerebellar synaptic plasticity. J Physiol 584:89-96, 2007.
- Kakegawa, W., Miyazaki, T., Hirai, H., Motohashi, J., Mishina, M., Watanabe, M., Yuzaki, M. Ca2+ permeability of the channel pore is not essential for the delta2 glutamate receptor to regulate synaptic plasticity and motor coordination. J Physiol 579.3:729-735, 2007.
- Hirai H, Pang Z, Bao D, Miyazaki T, Li L, Miura E, Parris J, Rong Y, Watanabe W, Yuzaki M*, Morgan JI. Cbln1 is essential for synaptic integrity and plasticity in the cerebellum. Nature Neurosci 8: 1534-1541, 2005. (*co-corresponding author)